Darkseid
Посвященный

Please,
Увійти
or
Реєстрація
to view URLs content!
Метамфетамин - рекреационный наркотик с очень высоким потенциалом злоупотребления, является мощным стимулятором центральной нервной системы. Благодаря своей липофильной природе он может легко пересекать ГЭБ и проникать в мозг, где высвобождает различные нейротрансмиттеры, взаимодействуя с различными рецепторами клеточной поверхности , которые могут вызывать нейротоксические эффекты в мозге. Истощение дофамина, окислительный стресс, активация астроцитов и клеток микроглии, аксональный транспортный барьер, аутофагия и апоптоз считаются основными факторами, которые играют решающую роль в нейротоксичности, вызванной МА. Однако полные молекулярные и клеточные механизмы, лежащие в основе нейротоксичности, вызванной МА, до сих пор неизвестны. На сегодняшний день не существует одобренного Управлением по контролю за продуктами и лекарствами (FDA) метода лечения нейротоксичности, вызванной МА, хотя проводится множество исследований для разработки эффективных терапевтических стратегий. Большинство исследований были сосредоточены на уменьшении эффектов нейротоксичности, вызванной МА, на основе основного механизма. В этой обзорной статье обсуждаются текущие исследования различных стратегий лечения, направленных на различные пути уменьшения нейротоксического воздействия МА на мозг. Хотя большинство исследований до сих пор было сосредоточено на использовании природных соединений , в настоящее время исследователи пытаются разработать эффективные таргетные методы лечения , такие как иммунотерапия , терапия на основе наночастиц и генная терапия, для лечения нейротоксичности, вызванной МА.
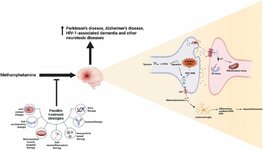
Для лечения нейротоксичности, вызванной МА, были адаптированы многие стратегии для достижения эффективных и действенных фармацевтических эффектов. Большинство стратегий лечения в настоящее время находятся на стадии клинических и доклинических исследований Стратегии лечения основаны на механизмах индукции нейротоксичности .
Краткое изложение потенциальных подходов к лечению нейротоксичности, вызванной МА:
| Терапия | Агент | Механизм |
|---|---|---|
| 1. Таргетная терапия окислительного стресса | Цинк, витамин C, антоцианин, байкалеин, изоликвиритигенин, трансциннамальдегид , альфа-токоферол и дефероксамин, пропофол, селен, талипексол, 6,7,4'-тригидрофлаванон. | Ослабляет окислительный стресс за счет снижения уровня АФК в клетках головного мозга и защиты от повреждения нейронов. |
| 2. Антиэксайтотоксичная терапия | Мелатонин, NAC, антагонисты NMDA (изоцилпин, клометиазол, топирамат, нейропептид Y) | Уменьшает эксайтотоксичность МА за счет уменьшения высвобождения глутамата, активирующего рецепторы NMDA и другие рецепторы глутамата. |
| 3. Таргетная терапия против митохондриальной токсичности | Литий, вальпроат, никотинамид, окситоцин | Ослабляет индуцированные МА изменения в экспрессии генов нескольких белков, связанных с функцией митохондрий и путями апоптоза. |
4. Противонейровоспалительная терапия | Модафинил, Ибудиласт, миноциклин, | Ингибирование активации микроглии представляется жизнеспособной стратегией снижения нейротоксичности, вызванной МА |
| 5. Терапия на основе наночастиц | Липосомальный мелатонин, нанодоставка церебролизина, | Повышенная нейропротекция благодаря более высокому проникновению |
| 6. Иммунотерапия | MH6-KLH, SMA-KLH, анти-МЕТ/АМФ mAb4G9, mAb7F9 | Стимулировать выработку антител, которые связываются с лекарствами после системной абсорбции МА, тем самым уменьшая количество лекарства, попадающего в ЦНС. |
| 7. Генная терапия | Lipo/siROCK2, антисмысловая кДНК PAG608 или малая интерферирующая РНК, аденовирусный вектор, кодируемый GPx-1 | Подавляет экспрессию генов (ROCK2, PAG608), способствующих МА-индуцированному апоптозу. |
| 8. Другие подходы | Белок паркина, цитокины, такие как IFN-γ, Δ9-THC, агонист CB2, CCK-8, 9cRA, 7,8-DHF, PFT-α, ингибиторы ренин-ангиотензина, ингибиторы MMP-9, пролактин, аромадендрин. | Стимулирование соответствующих целей |
1. Целенаправленная терапия против окислительного стресса
Многие исследования показали, что окислительный стресс является одной из основных причин нейротоксичности, вызванной МА. МА вызывает гибель дофаминергических клеток за счет увеличения производства АФК и снижения уровня клеточного АТФ. МА препятствует обратному захвату дофамина, что приводит к его аутоокислению и усилению метаболизма, что в конечном итоге приводит к выработке различных АФК, супероксида и радикалов азота, ответственных за апоптоз нейронов. Различные фармакотерапевтические методы были изучены на предмет эффективных и действенных стратегий лечения, которые защитят нейрональные клетки от окислительного стресса, вызванного МА. Было продемонстрировано, что многочисленные антиоксиданты обладают антинейротоксическими свойствами в отношении МА.Аджимапорн и др. (2007) продемонстрировали, что предварительная обработка цинком заметно снижает потерю жизнеспособности клеток , вызванную МА. Они обнаружили, что предварительная обработка цинка ZnCl 2 увеличивала экспрессию МТ и предотвращала образование АФК и истощение АТФ, вызванное МА . Многие исследования показали, что металлотионин, богатый цистеином внутриклеточный белок, может ингибировать активность АФК, таких как перекиси водорода и обеспечивает защиту клеток мозга от повреждения ДНК, вызванного химическими веществами или радиацией. Кроме того, МА-индуцированная экспрессия ASYN значительно снижалась при обработке раствором хлорида цинка . Возможная эффективность цинка в замедлении нейротоксического воздействия МА на ASYN требует дальнейшего изучения.
Витамин С защищает мозг от нейротоксичности, вызванной МА. Он уменьшает образование свободных радикалов , поддерживает гомеостаз глутатиона и способствует экспрессии гемоксигеназы 1 (HO-1), которая важна для предотвращения повреждения клеток головного мозга путем регуляции окислительно-восстановительного гомеостаза. Витамин С снижает выработку внутриклеточных АФК и защищает нейроны от токсичности МА, индуцируя экспрессию HO-1 через путь митоген-активируемой протеинкиназы p38 (MAPK) . Хуанг и др. продемонстрировали, что обработка клеток витамином С снижает уровни экспрессии беклина-1, легкой цепи 3-II (LC3-II) и расщепляемой каспазы-3, что указывает на защитные эффекты витамина С от нейротоксичности МА за счет ослабления генерации АФК. , апоптоз и аутофагия.
Было показано, что флавоноиды , являющиеся неферментативными антиоксидантами, эффективны при лечении нейротоксичности, вызванной МА. Антоцианин, флавоноид с мощными антиоксидантными свойствами, оказывает нейропротекторное действие, предотвращая гибель нейронов. Исследование, проведенное на модели усовых крыс, показало, что активное введение антоцианов в мозг подавляет окислительный стресс в мозге и изменения в дофамине. Антоцианин, наряду со значительным нейропротекторным действием, восстанавливал способность клеток буферизировать кальций, на который влияет окислительный стресс, вызванный дофамином и амилоидом-β
Please,
Увійти
or
Реєстрація
to view URLs content!
. Другой флавоноид, байкалеин , также продемонстрировал нейропротекторное действие, ингибируя потерю транспортера дофамина в полосатом теле, вызванную нейротоксичностью, вызванной МА. Он действует путем ингибирования перекисного окисления липидов и выработки АФК нейтрофилами
Please,
Увійти
or
Реєстрація
to view URLs content!
. Ли и др. показали, что изоликиритигенин , флавоноид со структурой халкона , значительно предотвращает МА-индуцированный транспорт дофамина и снижение тирозингидролазы при внутрибрюшинном введении до воздействия МА. Он также подавлял активацию глиальных клеток и ингибировал экспрессию NOS и NF-ҡa, транскрипционного фактора, активируемого путем блокирования фосфорилирования. Другой природный флавоноид, коричный альдегид , присутствующий в растении Cinnamomum cassia, также продемонстрировал нейропротекторное действие на цитотоксичность, индуцированную МА
Please,
Увійти
or
Реєстрація
to view URLs content!
. Рашиди и др. ал. в своем недавнем исследовании показали, что трансциннамальдегид(TCA) оказывает защитное действие против нейротоксичности, вызванной МА, подавляя цитотоксичность и окислительный стресс. Было также показано, что тимохинон (TQ), основной компонент растенияNigella sativa, оказывает защитное действие против токсичности МА
Please,
Увійти
or
Реєстрація
to view URLs content!
. Рухбахш и др. ал. продемонстрировали, что TQ может оказывать нейропротекторное действие против нейротоксичности, вызванной МА, и гиперлокомоторной активности у мышей благодаря своим антиоксидантным свойствам. Ли и др. al показали терапевтический потенциал 6,7,4'-тригидроксифлаванона (ТГФ) против нейротоксичности, вызванной МА. Они заметили, что ТГФ, природное соединение, выделенное из растенияDalbergia odorifera,проявляет защитные эффекты против нейротоксичности, вызванной МА, путем регуляции индуцированного МА окислительного стресса, модулируя экспрессию белков, связанных с апоптозом. Они обнаружили, что ТГФ индуцирует ядерную транслокацию ядерного фактора эритроидного 2-родственного фактора 2 (NrF2), усиливая выработку цитопротекторного фермента HO-1 через сигнальный путь PI3K/Akt/mTOR. В другом своем исследовании Lee et. ал. показали, что аромадендрин, выделенный из Chionanthus retusus, защищает клетки от МА-индуцированной нейротоксичности, регулируя стресс ER и пути PI3K/AKT/mTOR . Они заметили, что предварительное лечение аромадендрином восстанавливало экспрессию антиапоптотических белков после лечения МА, что указывает на защитную роль аромадендрина против нейротоксичности, вызванной МА. Эти результаты позволяют предположить, что небольшие молекулы из семейства флавоноидов потенциально могут использоваться для лечения нейротоксичности, вызванной МА.Пак Ли и др. показали, что α-токоферол (α-ТФ) и дефероксамин (ДФО) предотвращают стресс, вызванный окислительным и перекисным окислением липидов, что приводит к снижению уровня повреждения нейронов из-за токсичности МА . α-ТФ представляет собой поглотитель АФК с антиоксидантной активностью , который, отдавая свой атом водорода, защищает клетки от токсического воздействия АФК . Хименес и др. продемонстрировали, что МА, введенный вместе с α-ТФ, частично инвертировал нейротоксическое действие и апоптотические свойства в гранулах мозжечка. ДФО, хелатирующий агент , снижает концентрацию окислительных радикалов, ингибируя катализируемое железом образование радикалов. ДФО значительно уменьшает отек и нарушение ГЭБ за счет снижения уровня свободного железа. Парк и др. в своем исследовании показали, что низкая доза ДФО (50 мг/кг) уменьшала снижение содержания ДА и серотонина в полосатом теле, вызванное повторным введением МА. Хелатирование свободного железа с ДФО предотвращает образование гидроксильных радикалов , вызванное МА, тем самым уменьшая истощение ДА и серотонина . Пропофол , седативно-снотворное средство для внутривенного введения, имеет химическую структуру, аналогичную структуре альфа-токоферола, и оказывает антиоксидантное действие на различных экспериментальных моделях . В исследовании, проведенном Шокрзаде и др., пропофол использовался для ослабления нейротоксичности, вызванной МА, у крыс. Они обнаружили, что пропофол значительно снижает перекисное окисление липидов и выработку АФК в тканях мозга и митохондриях, выделенных из мозга. Они также заметили, что пропофол ослабляет МА-индуцированное окисление глутатиона , что можно коррелировать с выработкой антиоксидантных ферментов , и было обнаружено, что он значительно обращает вспять МА-индуцированную митохондриальную токсичность, ингибируя открытие пор переходной проницаемости митохондрий , коллапс потенциала митохондриальной мембраны и ингибирование митохондриальный путь передачи сигналов апоптоза. Они обнаружили, что введение пропофола может быть многообещающим подходом для защиты от нейротоксичности, вызванной МА.
Селен — это природный минерал, который содержится в почве, пище и воде. Его часто поставляют в качестве пищевой добавки и антиоксиданта . Ким и др. исследовали потенциальное влияние пищевого селена на нейротоксичность дофаминергических нейронов. Они обнаружили, что активность глутатионпероксидазы (GPx) и соотношение восстановленного глутатиона GSH к окисленному глутатиону GSSG в мозжечке , гиппокампе, стриатуме и черном субстрате у мышей, получавших МА, резко увеличивались после восполнения запасов селена, что указывает на ослабление нейротоксичности МА за счет GPx-опосредованные антиоксидантные механизмы
Please,
Увійти
or
Реєстрація
to view URLs content!
. Имам и др. показали, что лечение селеном предотвращает истощение DA и его метаболитов, DOPAC и гомованилиновой кислоты (HVA) в хвостатом ядре в результате лечения MA . Когда нейрональные клетки SH-SY5Y обрабатываются селеном, усиленный окислительный стресс, вызванный МА, обращается вспять, вероятно, из-за снижения уровней GPx . Однако из-за узкого терапевтического диапазона прием добавок селена следует проводить с осторожностью, чтобы свести к минимуму возможные негативные эффекты.Лица, злоупотребляющие МА, с большей вероятностью заболеют болезнью Паркинсона. Было обнаружено, что талипексол , противопаркинсонический агент , значительно реагирует с гидроксильными радикалами по механизму реакции, аналогичному МА-индуцированной нейротоксичности, демонстрируя нейропротекторный эффект талипексола. Более того, Киш и др. заявили, что замена DA потенциально может восстановить дефицит DA в полосатом теле, вызванный MA . Эти результаты показывают, что противопаркинсонические препараты и методы лечения, нацеленные на области мозга, могут облегчить эффекты МА в мозге.
2. Антиэксайтотоксичная терапия
Как обсуждалось ранее, эксайтотоксичность МА вызвана более высоким высвобождением глутамата, активирующего NMDA- рецепторы и другие глутаматные рецепторы, что приводит к высокому притоку Ca 2+ и активирует ряд клеточных активностей. Таким образом, эти рецепторы считаются потенциальными сайтами для воздействия на эксайтотоксичность, индуцированную МА, и вызывают большой интерес в разработке таргетной терапии .Мелатонин , гормон шишковидной железы , обладает потенциальным защитным действием против окислительного стресса и контролирует внутриклеточное движение ионов кальция в ЦНС . Эктувапрани и др. исследовали влияние мелатонина на вызванные МА изменения в пролиферации клеток . В этом исследовании, проведенном на клетках-предшественниках гиппокампа взрослых крыс Wistar , MA-индуцированные изменения уровней экспрессии субъединиц рецептора NMDA , NR2A и NR2B, а также Ca 2+-зависимой протеинкиназы . Они заметили, что предварительное лечение мелатонином уменьшало эффекты, вызванные МА, что указывает на защитное действие мелатонина против пролиферации и нейрогенеза , возникающих в результате воздействия МА, и предотвращает вызванные МА нарушения памяти и обучения. Ноппарат и др. исследовали фундаментальное действие мелатонина на нейротоксичность, вызванную МА. Они обнаружили, что мелатонин играет полезную роль в предотвращении генерации Aβ в клеточной модели БА, индуцированной МА. Эти наблюдения предполагают потенциальную роль мелатонина в защите от митохондриальной дисфункции, дофаминергической дегенерации и апоптоза, которые считаются мощными факторами нейротоксичности, вызванной МА.
Многие исследователи также изучали эффекты N-ацетилцистеина (NAC), предшественника антиоксиданта глутатиона, на моделях, обработанных МА, из-за его широкой эффективности против различных неврологических расстройств. NAC обладает антиоксидантной активностью и снижает возбуждающую токсичность глутамата, модулирует высвобождение DA , улучшает митохондриальную дисфункцию и снижает уровень провоспалительных цитокинов. Хашимото и др. в исследовании in vitro, проведенном на обезьянах, продемонстрировали, что предварительное внутривенное болюсное введение и последующая непрерывная инфузия NAC в модели, подвергшейся воздействию МА, значительно снижали снижение транспорта дофамина. Чжан и др. показали, что обработка NAC-амином у мышей, подвергшихся воздействию МА, значительно снижает окислительный стресс в мозге, печени и почках за счет ослабления восстановления глутатиона и увеличения активности глутатиона, тем самым предполагая терапевтический потенциал этого препарата в лечении токсичности, вызванной МА .
Некоторые антагонисты NMDA предотвращают нейротоксичность, вызванную МА. Болдуин и др. ал. показали, что изоцилпин, мощный неконкурентный ингибитор рецепторов NMDA, оказывает эффективное защитное действие против токсичности, вызванной МА, предотвращая сверхактивность рецептора NMDA после высвобождения DA. Было обнаружено, что другой препарат, клометиазол , производное тиазола с седативным и снотворным действием, оказывает нейропротекторное действие против нейротоксичности, вызванной МА, путем ингибирования высвобождения дофамина и, в некоторой степени, путем ингибирования эффектов, опосредованных NMDA . По данным Ма и др. Топирамат , противосудорожный препарат , обладает более высоким потенциалом снижения возбуждающей токсичности, вызванной МА. Они предположили, что топирамат действует путем антагонизма множества рецепторов Glu, блокирования потенциал-зависимых Na+-каналов и ингибирования карбоангидразы . Нейропептид Y (NPY) оказывает нейропротекторное действие при ряде патологических состояний. Баптиста и др. показали, что индуцированная МА гибель клеток предотвращается путем активации рецепторов Y1 или Y2, а подтип Y1 отвечает за предотвращение индуцированной МА дифференцировки нейронов.
Тетрагидропальматин (ТГП), активный компонент травяных растений родов Stephania и Corydalis, оказывает седативное, снотворное и обезболивающее действие . THP является антагонистом дофаминовых рецепторов и, как сообщается, используется для лечения наркозависимости. Было показано, что THP оказывает нейропротекторное действие против нейротоксичности, вызванной МА . Лю и др. ал. продемонстрировали, что THP может облегчить нейротоксичность, вызванную МА, путем регулирования нейротрофического фактора головного мозга (BDNF) посредством взаимодействия между рецептором тирозинкиназы B (TrkB)/кальмодием (CAM). Понижение уровня BDNF связано с нейротоксичностью, вызванной МА. THP уменьшает приток Ca2+, что приводит к снижению САМ, увеличивает TrkB и фосфорилирует Akt. Это приводит к повышению уровня регуляции NF-κB и BDNF, тем самым ингибируя апоптоз и МА-индуцированную нейротоксичность.
3. Таргетная терапия против митохондриальной токсичности
Повышение активности митохондрий может помочь уменьшить пластичность нейронов и дефицит клеточной устойчивости, связанный с некоторыми нейропсихиатрическими заболеваниями. Исследования in vivo , проведенные Bachmann et al. (2009) на клетках SH-SY5Y показали, что длительная терапия литием или вальпроатом (VPA) защищает от МА-индуцированного повреждения на митохондриальном уровне. Вызванные МА изменения в экспрессии генов нескольких белков, связанных с функцией митохондрий и путями апоптоза, ослабляются литием или вальпроатом , что указывает на клиническую полезность этих препаратов при нейротоксичности, индуцированной МА. МА может ингибировать комплексы дыхательной цепи митохондрий за счет снижения активности ферментов цикла Кребса. Литий и VPA обращают вспять вызванную МА дисфункцию энергетического метаболизма. Однако эффект этих препаратов зависит от задействованных ферментов и частей мозга, что указывает на неоднородность параметров окислительного стресса в разных областях мозга .Было обнаружено, что никотинамид , кофактор в цепи переноса электронов и предшественник никотинамидадениндинуклеотида (НАД), эффективен при лечении митохондриальных энцефалопатий. В исследовании, проведенном Huang et al., лечение никотинамидом перед введением МА приводило к снижению содержания ДА и АТФ в полосатом теле, что указывает на ослабление токсического эффекта МА .
Окситоцин, нейропептид , вырабатываемый в гипоталамусе и высвобождаемый задней долей гипофиза , также оказывает защитное действие против токсичности, вызванной МА. Ли и др. ал. изучил нейропротекторное действие окситоцина против МА-индуцированного повреждения нейронов у крыс. Они обнаружили, что повреждение нейронов гиппокампа, вызванное лечением МА, предотвращается предварительной инкубацией с окситоцином. Предварительная обработка окситоцином ослабляет мембранный потенциал митохондрий и выработку АФК путем регулирования МА-индуцированных изменений апоптотических белков в нейронах гиппокампа. Обработка окситоцином усиливала экспрессию расщепленной каспазы-3 и снижала экспрессию Bcl-2/Bax, стимулированную обработкой МА. Окситоцин ослабляет апоптоз, индуцированный МА, посредством активации рецептора окситоцина в области гиппокампа. Участие активации рецептора окситоцина в нейропротекторном эффекте окситоцина против токсичности , вызванной МА, было подтверждено путем предварительной инкубации с антагонистом рецептора окситоцина атозибаном . Предварительное лечение атозибаном значительно предотвращало опосредованные окситоцином изменения в нейронах гиппокампа, что подтвердило связь нейропротекторных эффектов окситоцина с рецептором окситоцина.
4. Противонейровоспалительная терапия
Нейровоспаление играет важную роль в возникновении нейротоксичности вследствие воздействия МА, а также является наиболее вероятным последствием повреждения, вызванного МА. Поскольку существует множество медиаторов и путей нейровоспаления, существует также множество конечных точек, которые представляют собой повреждение, вызванное МА. Нейротоксичность МА в основном обусловлена воспалительной реакцией, генерируемой активированной микроглией. Секин и др. ал. в своем исследовании предположили, что хроническое самостоятельное введение МА может вызвать реактивный микроглиоз в мозгу людей, злоупотребляющих МА . Таким образом, ингибирование активации микроглии представляется жизнеспособной стратегией снижения нейротоксичности, вызванной METH. Миноциклин , тетрациклин второго поколения , обладает как противовоспалительным, так и нейропротекторным действием и является мощным ингибитором активации микроглии и путей апоптоза. Исследование Чжана и др. ал. показали, что миноциклин значительно ослаблял увеличение внеклеточных уровней DA и иммунореактивности DAT после повторного введения МА. Они предположили, что миноциклин можно использовать для инактивации микроглии и, следовательно, для лечения некоторых симптомов , связанных с воздействием МА. Ибудиласт , неселективный ингибитор фосфодиэстеразы , повышает уровень глиального нейротрофического фактора (GFNF) в головном мозге и ослабляет активацию микроглии и цитокинов, ответственных за воспаление. Модафинил, умный препарат, улучшающий когнитивные функции, также предотвращает МА-индуцированную активацию микроглии в головном мозге, тем самым снижая вероятность нейровоспаления.5. Терапия на основе наночастиц
В случае нейротоксичности, вызванной психостимуляторами, лечение обычным препаратом в стандартной дозе не вызывало удовлетворительной нейропротекции . Поэтому всегда существует потребность в повышении дозы или частоты введения этих терапевтических препаратов для достижения значительной нейропротекции. Терапия на основе наночастиц считается более эффективной, чем исходные препараты. Наночастицы обладают лучшим терапевтическим эффектом из-за лучшего проникновения в ЦНС в высоких концентрациях. Это приведет к медленному и контролируемому высвобождению терапевтических агентов в течение длительного периода времени. Нгуен и др. провели эксперимент, чтобы продемонстрировать эффективность липосомальной доставки мелатонина при окислительной нагрузке, вызванной МА. Хотя мелатонин может проходить через ткань и достигать клеточного компартмента из-за своей небольшой молекулярной массы и амфифильной природы, эта терапия имеет определенные недостатки из-за короткого периода полураспада и низкой растворимости в воде, что приводит к вариабельности пероральной абсорбции . Таким образом, Нгуен и др. использовали липосомы для улучшения растворимости и абсорбции лекарств . Они заметили, что липосомальный мелатонин был более эффективен, чем мелатонин, в отношении нейротоксичности, вызванной МА, у мышей. Липосомальный мелатонин значительно ослаблял гипертермию, окислительное повреждение, митохондриальную дисфункцию, проапоптотические изменения и дофаминергическую потерю за счет инактивации протеинкиназы C-δ . Эффективность нанодоставки Церебролизина или H-290/51 при нейротоксичности, вызванной МА, изучалась на моделях крыс при высоких и низких температурах окружающей среды Sharma et al. Они показали, что стандартная доза H-290/51 (50 мг/кг) или церебролизина (2,5 мл/кг) при доставке с использованием нанопроволок TiO 2 наблюдала значительную нейропротекцию. Эти исследования показывают, что терапия на основе наночастиц может быть лучшим вариантом с повышенной эффективностью для лечения нейротоксичности, вызванной МА. Кроме того, наночастицы также можно использовать для визуализации и обнаружения МА при интоксикации МА .6. Иммунотерапия
Иммунотерапия в форме пассивной иммунизации (моноклональные антитела) может использоваться для уменьшения количества лекарства, попадающего в ЦНС, путем стимуляции выработки антител , которые связываются с лекарствами после системной абсорбции МА. Было проведено множество исследований зависимости и токсичности МА с использованием пассивной иммунизации моноклональными антителами , и они изучались с возобновлением интереса, хотя в некоторых предыдущих исследованиях были получены противоречивые результаты . Исследование, проведенное Miller et al. На крысах было показано, что у крыс, которым вводили гемоцианин улитки улитки (KLH), конъюгированный с метамфетаминоподобной гаптеновой вакциной (MH6-KLH) и вакциной сукцинил МА (SMA-KLH), наблюдались повышенные уровни МА в сыворотке и сниженные уровни в мозге после острой МА. инъекция. Они предположили, что эта антиметамфетаминовая вакцина стимулирует нейропротекцию против нейротоксичности, вызванной МА. В другом исследовании, проведенном с использованием mAb4G9 против METH/AMP, было показано, что оно защищает мозг крыс от повреждения, вызванного МА. Баллестер и др. показали, что связывание человеческого моноклонального антитела с метилфенидатом (mAb7F9) приводило к значительному снижению концентрации МА, поступающей в мозг. Было обнаружено, что комбинированный метод с использованием моноклональных и поликлональных антител более эффективен для достижения более высокого ответа антител против МА и снижения уровня МА в мозге. Хотя вакцинная иммунотерапия вызывает рост интереса к лечению МА, существуют определенные ограничения, в том числе отсутствие полной блокады действия препарата, задержка адекватной выработки циркулирующих антител, вариации в титрах антител и неспособность препарата проникать через ГЭБ, что делает его неэффективно дорогим.7. Генная терапия
Rho-ассоциированная киназа II (ROCK2) является многообещающей мишенью для генной терапии. Ингибирование ROCK2 защищает клетку при различных патофизиологических состояниях. Злоупотребляющие МА связаны с развитием БП , а подавление ROCK2 защищает нейроны от токсичности МА. Считается, что ROCK играют значительную роль в патогенезе БП, а также идентифицируются как потенциальная терапевтическая мишень при нейротоксичности, индуцированной МА, в исследованиях in vitro, что заложило основу для будущих исследований in vivo. В исследовании, проведенном Янгом и др., воздействие МА увеличивало экспрессию белка ROCK2 в клетках P12. Они показали, что воздействие МА приводит к дезориентации дендритных ветвей и укорочению длины нейритов , а восстановление морфологии было достигнуто в клетках P12, обработанных липофектамином 2000 (Lipo)/одиночным мешающим ROCK2. Lipo/siROCK2 значительно уменьшал апоптоз, индуцированный МА, повышал жизнеспособность клеток и обращал вспять морфологические изменения, вызванные воздействием МА на уровне P12. Эти результаты позволяют предположить, что ROCK2 является потенциальной мишенью для лечения нейротоксичности, вызванной МА. При апоптозе нейрональных клеток, вызванном окислительным стрессом, проапоптотический ген PAG608 активируется и контролируется экспрессией p53. Исследования показали, что подавление PAG608 с помощью антисмысловой кДНК PAG608 или небольшой интерферирующей РНК снижает токсичность, вызванную МА. Это позволяет предположить, что нейротоксичность, индуцированная МА, в некоторой степени связана с индукцией экспрессии PAG608 в моноаминергических клетках, что делает его возможной мишенью для терапевтического подхода.GPx считается основным антиоксидантным ферментом, катализирующим H 2 O 2 на воду и спирт. Шарма и др. ал. в одном из своих результатов было высказано предположение, что селен-зависимая глутатионпероксидаза (GPx-1) проявляет защитную роль против нейротоксичности, вызванной МА. Они сконструировали аденовирусный вектор , кодирующий ген GPx-1 (Ad-GPx-1), чтобы доказать защитную роль GPx-1 при нейротоксичности, вызванной MA. Они наблюдали повышенную активность GPx и уровень белка GPx-1 у мышей, нокаутных по GPx-1 , а также обнаружили, что взаимодействие между NF-κB и GPx-1 важно для нейропротекторных эффектов. Лечение Ad-GPx-1 значительно снижало МА-индуцированную потерю дофаминергических гормонов за счет сверхэкспрессии гена GPx-1 . Они успешно продемонстрировали, что терапия Ad-GPx-1 может предотвратить дофаминергическую токсичность после злоупотребления МА.
8. Другие подходы к защите от нейротоксичности, вызванной МА
Паркин, убиквитин-белковая лигаза Е3, является частью убиквитиновой протеасомной системы, которая обеспечивает нацеливание белков на деградацию. Снижение функции паркина приводит к дегенерации нейронов DA, а сверхэкспрессия паркина защищает DA от различных клеточных повреждений, включая те, которые участвуют в опосредовании нейротоксичности МА. Паркин защищает нейроны DA в черной субстанции от нескольких атак, таких как гидроксидофамин и белков сверхэкспрессии, таких как ASYN и тау. Ло Бьянко и др. показали, что на крысиной модели ASYN, имитирующей условия болезни Паркинсона, доставка паркина лентивирусным вектором минимизировала дофаминергическую деградацию. У крыс, получавших МА, увеличение уровней паркина снижало индуцированное МА снижение иммунореактивности тирозингидроксилазы полосатого тела , что указывает на защитное действие паркина на дофаминергические окончания против нейротоксичности, индуцированной МА.Цитокины, такие как интерферон (ИФН)-γ, могут оказывать различные эффекты на ЦНС. IFN-γ представляет собой воспалительный цитокин, который имеет решающее значение как для врожденного, так и для адаптивного иммунитета. Ю и др. продемонстрировали, что лечение МА значительно снижает выработку IFN-γ. Ходзуми и др. изучали нейропротекторное действие IFN-γ на индуцированную МА нейротоксичность полосатого тела у мышей. Они показали, что внутрибрюшинное и интрацеребровентрикулярное введение IFN-γ перед воздействием МА значительно предотвращало МА-индуцированное снижение DAT, что указывает на защитный эффект IFN-γ против МА-индуцированной нейротоксичности.
Многие исследования in vitro и in vivo показали, что природные каннабиноиды , такие как Δ9-тетрагидроканнабинол (Δ9-THC), каннабинол и синтетический агонист рецептора CB , могут ослаблять экспериментально индуцированную нейротоксичность при патологических состояниях, таких как глутаматная эксайтотоксичность , гипоксия , ишемический инсульт , поражение головного мозга . травма и окислительный стресс. Кастелли и др. исследовали нейропротекторное действие Δ9-ТГК на нейротоксичность, вызванную МА. Они заметили, что до и после обработки Δ9-ТГК значительно снижалась МА-индуцированная сверхэкспрессия nNOS в хвостатой скорлупе (CPu) и иммунореактивность GFAP в префронтальной коре . Они показали, что Δ9-ТГК снижает повреждение головного мозга, вызванное МА, ингибируя сверхэкспрессию nNOS и активацию астроцитов, что указывает на потенциальную роль Δ9-ТГК в ослаблении нейротоксичности, индуцированной МА
Please,
Увійти
or
Реєстрація
to view URLs content!
. Другое исследование, проведенное Torres et al. показали потенциальный нейропротекторный эффект каннабиноидного агониста CB2 против МДМА , производного МА, индуцируемую нейротоксичность и способность этого соединения ингибировать высвобождение IL-1β и активацию микроглии в лобной коре и гипоталамусе крыс, получавших МДМА, что позволяет предположить, что рецептор CB2 является потенциальной мишенью нейротоксичности, вызванной лекарственными средствами.Пептид кишечника и мозга холецистокинин (CCK) обладает широким спектром биологического действия в желудочно-кишечном тракте и ЦНС. CCK-8 играет важную роль в обучении и памяти, а также в патогенезе некоторых заболеваний головного мозга . Он действует как модулятор/нейротрансмиттер и модулирует высвобождение нейротрансмиттеров, таких как DA и гамма-аминомасляная кислота (ГАМК). В предыдущих исследованиях было доказано, что CCK-8 обладает антиоксидантными и противовоспалительными свойствами. Кроме того, он проявляет нейропротекторные свойства в моделях нервных повреждений. Гау и др. показали, что предварительное лечение CCK-8 снижает гиперлокомоцию, поведенческую сенсибилизацию, стереотипное поведение и дофаминергическую нейротоксичность, вызванную воздействием МА, что позволяет предположить, что CCK-8 является важным терапевтическим агентом для лечения нейротоксичности, индуцированной МА.
Другие препараты, изучаемые для лечения нейротоксичности, вызванной МА, включают 9- цис -ретиноевую кислоту (9cRA), 7,8-дигидроксифлавон и (PFT-α) и т. д. . Райнер и др. ал. продемонстрировали, что производные витамина А, 9cRA, биологически функционирующие, восстанавливают МА-индуцированное снижение иммунореактивности и смертности Т-хелперных клеток в первично культивируемых дофаминергических нейронах. Рен и др. обнаружили, что 7,8-ДГФ резко снижает DAT и активацию микроглии в полосатом теле мышей после воздействия МА, что позволяет предположить защитную роль 7,8-ДГФ в снижении нейротоксичности, вызванной МА. Аналогичным образом, Чен и др. ал. продемонстрировали, что лечение ингибитором р53, PFT-α, противодействует поведенческим нарушениям, опосредованным МА, у мышей. Воздействие МА снижает иммунореактивность тирозингидроксилазы и увеличивает опосредованное терминальной дезоксинуклеотидилтрансферазой мечение ник-конца dNTP , а PFT-α противодействует этим реакциям. Эти данные свидетельствуют о том, что PFT-α оказывает нейропротекторное действие против МА-индуцированной нейродегенерации посредством транскрипционно-зависимых и независимых путей.
Нейротоксичность, вызванная МА, обусловлена главным образом дисбалансом уровня ДА и дегенерацией ГЭБ. Повреждение ГЭБ может привести к выбросу токсичных и вредных веществ в ЦНС, вызывая нейротоксические эффекты. Ренин- ангиотензиновая система, ингибиторы ММП-9 и пролактин продемонстрировали защитные эффекты при нейротоксичности, вызванной МА. Чжао и др. ал. суммировали терапевтические преимущества ренин-ангиотензиновой системы , ингибиторов ММП-9 и пролактина. Ренин-ангиотензиновая система регулирует уровень DA, ингибиторы MMP-9 уменьшают поведенческую сенсибилизацию за счет снижения уровня DA, а пролактин регулирует плотное соединение и поддерживает целостность ГЭБ.
Останнє редагування: